Nuôi trồng thủy sản là một trong những ngành thực phẩm phát triển nhanh nhất các ngành sản xuất trên thế giới.
Sự gia tăng dân số thế giới đòi hỏi phải tăng trưởng nhanh hơn trong nuôi trồng thủy sản để có nguồn thức ăn tốt hơn. Nhưng sự tăng trưởng toàn cầu này làm cho nuôi trồng thủy sản bị ảnh hưởng bởi dịch bệnh, đặc biệt là bệnh do vi khuẩn trong quá trình nuôi.
Nguồn gốc
Bacteriocin như peptide kháng khuẩn (AMP) phân bố rộng khắp ở động vật có xương sống nhóm, bao gồm cả con người (cathelicidin, defensins và protegrins), chim (Enterocin 012, peptit dị hợp gà (CHP1 & CHP2), peptide dị dưỡng gà tây (THP1, THP2 & THP3)), lưỡng cư (magainin, dermaseptin, brevinin và esculentin), côn trùng (mastoparan, poneratoxin, cecropin, moricin, melittin), thực vật (thionin, defensin và chuyển lipid protein) và vi sinh vật (pediocin, leucocin, mesentericin, sakacin và curvacin).
Bacteriocin được thấy ở cả vi khuẩn Gram âm và Gram dương. Tuy nhiên bacteriocin từ vi khuẩn gram dương có sự quan tâm nhiều hơn ở vi khuẩn Gram âm vì nhiều lý do: chúng thường được tìm thấy ở nhiều vi khuẩn axit lactic có ích về mặt thương mại LAB (lactococci, lactobacilli, pediococci) và những vi khuẩn đó nói chung là được coi là an toàn (GRAS) cho con người, vì chúng được tìm thấy hoặc sử dụng trong các sản phẩm lên men thực phẩm và thức ăn chăn nuôi).
Hơn nữa, chúng không độc đối với tế bào nhân chuẩn và chúng có phổ ức chế rộng hơn nhiều so với bacteriocin từ vi khuẩn Gram âm. Ngoài ra, một số bacteriocin còn có tác dụng trực tiếp chống lại vi khuẩn gây bệnh trong nuôi trồng thủy sản và trong điều trị một số bệnh nhiễm trùng do vi khuẩn và an toàn thực phẩm.
Phân loại bacteriocin
Các bacteriocin được chia thành các nhóm khác nhau, các lớp dựa trên các tiêu chí khác nhau như sinh vật sản xuất, kích thước phân tử, tính chất vật lý, cấu trúc hóa học, phương thức hoạt động, v.v. đôi khi có những tên gọi khác nhau cho cùng một hợp chất như thiolbiotics và lantibamel; microcins và colicin, bacteriocin.
Loại I (Lantibiotic): Kích thước nhỏ và cation peptit có kích thước từ 2 đến 9 kDa trong khối lượng phân tử, tác động đến màng tế bào của vi khuẩn, phá vỡ cấu trúc thành phần tế bào và dẫn đến chết tế bào vi khuẩn.
Loại II (Ổn định nhiệt – nonlantibiotics: Bao gồm lớp IIa đến lớp IIe.
Loại III (Không bền nhiệt): Bao gồm các protein có hoạt tính enzyme gây ra sự thoái hóa thành tế bào và điều này nhóm kháng sinh được gọi là chất phân giải vi khuẩn.
Loại IV (Bacteriocin tuần hoàn): Các bacteriocin loại IV được biến đổi sau dịch mã với đặc tính duy nhất là được tuần hoàn hóa (từ đầu đến đuôi), chúng được tạo ra bởi máy móc tổng hợp phức tạp hơn và chúng được khép kín theo cấu trúc tuần hoàn.
Cơ chế hoạt động của bacteriocin
Vì bacteriocin là các phân tử sinh học nên chúng thể hiện đặc tính đối kháng của chúng và ức chế mầm bệnh bằng cách thu hút các yếu tố sinh học khác nhau theo những cách khác nhau như được mô tả dưới đây.
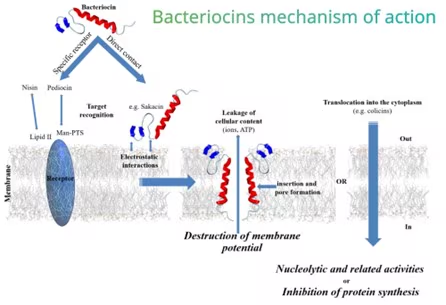
Cơ chế diệt khuẩn của bacteriocin
Giảm điện thế xuyên màng: Bacteriocin loại I ức chế các tế bào mục tiêu bằng cách hình thành các lỗ trên màng, làm suy giảm điện thế xuyên màng khoảng từ 80 đến 100 mV, cuối cùng làm giảm độ pH và chuyển ion dẫn đến rò rỉ tế bào vật liệu.
Sự tương tác tĩnh điện: Bacteriocin là những phân tử mang điện tích dương các mảng kỵ nước. Đây là những tĩnh điện tương tác với photphat tích điện âm các nhóm hiện diện trên màng tế bào đích và được cho là góp phần vào sự ràng buộc ban đầu với màng đích. Có ý kiến cho rằng phần kỵ nước của bacteriocin sẽ chèn vào màng và hình thành lỗ xuyên màng.
Ức chế sinh tổng hợp: Cơ chế này đã được chứng minh rõ ràng đối với merscidin và nisin, cả hai đều sử dụng lipid II, tiền chất peptidoglycan đóng vai trò là phân tử gắn kết. Merscidin cũng ức chế sự tổng hợp peptidoglycan trong khi phương thức hoạt động chính của nisin là hình thành lỗ dẫn đến rò rỉ tế bào vật liệu. Bacteriocin không có tác dụng như nhau đối với loài mục tiêu, nhưng các nhà nghiên cứu đã kiểm tra rằng ái lực của bacteriocin với các loài cụ thể và chủng.
Thông thường, thành phần phospholipid của chủng mục tiêu và pH môi trường ảnh hưởng đến giá trị nồng độ ức chế tối thiểu (MIC). Thay vì sự hình thành lỗ xuyên màng xảy ra một cách tự nhiên, có vẻ như việc lắp ghép các phân tử trên màng tế bào đích tạo điều kiện thuận lợi tương tác với bacteriocin và ức chế tổng hợp các phân tử sinh học, do đó làm tăng hiệu quả của bacteriocin.
Ức chế hình thành vách ngăn: Có bằng chứng cho thấy bacteriocin loại II thực sự ức chế sự hình thành vách ngăn ở vi khuẩn, nhưng một số bacteriocin có chứa peptit cation gây ra sự khử cực màng không phải lúc nào cũng tương ứng với MIC và không nhất thiết gây chết tế bào. Việc xâm nhập vào có thể tác động đến DNA, RNA, enzyme và các vị trí khác tiêu diệt tế bào đích.
Tương tác với vị trí cụ thể: Một số bacteriocin cũng tương tác với các vị trí cụ thể trên màng tế bào đích, có thể là protein, trong khi sự tương tác này có thể tăng hiệu quả của bacteriocin trong điều kiện in-vivo.
Độ dốc điện áp và thực thể giống thụ thể: Nó đã được chứng minh rằng lỗ xuyên màng độc lập điện áp được hình thành bởi pediocin PA1 và lactococcin A. Các túi thấm được hình thành bởi Lactococcin A nhạy cảm trong khi liposome được tạo ra từ cùng loại tế bào không bị ảnh hưởng. Người ta cũng đề xuất rằng cần có một thực thể giống thụ thể trên bề mặt tế bào để ức chế tế bào.
Việc xác định các cơ chết diệt khuẩn của bacteriocin sẽ cung cấp nguồn gốc của chất kháng khuẩn có cấu trúc độc đáo trong tương lai và những peptide này có thể được sử dụng như các mô hình để nghiên cứu cơ chế phòng trị bệnh mức độ sinh phân tử.

